МУ 4865: Определение отношения CP/CV для воздуха методом Клемана-Дезорма
Лабораторная работа 1-7: Определение отношения CP/CV для воздуха методом Клемана-Дезорма
Цель работы: экспериментальное определение показателя адиабаты CP/CV для воздуха и изучение особенностей адиабатического процесса.
Приборы и принадлежности: установка Клемана-Дезорма, манометр, насос, секундомер.
Элементы теории и метод эксперимента
Адиабатным (адиабатическим) называют термодинамический процесс, происходящий в термодинамической системе без подвода теплоты. С достаточным приближением такой процесс можно отнести к процессу при быстром изменении объема. Первое начало термодинамики для произвольного термодинамического процесса имеет вид
$$dQ=dU+dA$$
или
$$\delta Q=dU+\delta A$$
Формула 1
Здесь δQ − бесконечно малое количество теплоты, подводимое к термодинамической системе; dU − бесконечно малое изменение внутренней энергии системы; δA − бесконечно малая работа, совершаемая термодинамической системой в результате данного процесса.
Отличия в записи (δQ, δA и dU) малых величин количества теплоты, работы и изменения внутренней энергии выражают физические отличия этих величин: внутренняя энергия системы является функцией её состояния, количество теплоты и работа являются функциями процесса.
По определению теплоемкости
$$С=\frac {\delta Q}{dt}=\frac {dU}{dT}+\frac {\delta A}{dT}$$
Формула 2
Поскольку передаваемое газу количество теплоты δQ зависит от характера происходящего при этом процесса (способа нагрева газа), теплоемкость С также является функцией процесса: один и тот же газ в зависимости от происходящего в нем при нагревании процесса имеет различные теплоемкости. Состояние газа как термодинамической системы определяется параметрами: давлением p, объемом V и температурой T, связь которых определяется уравнением состояния. Уравнением состояния идеального газа является уравнение Менделеева − Клапейрона, которое для одного моля газа имеет вид
$$pV=RT$$
Формула 3
где R – универсальная газовая постоянная. Далее для простоты будем считать, что количество газа остается постоянным и равным одному молю.
Процессы, протекающие в газе при неизменном значении одного из термодинамических параметров его состояния, называются изопроцессами.
- Изохорный процесс протекает при постоянном объеме (V=const). Уравнение изохоры (закон Шарля) имеет вид:
$$\frac {p}{T}=const$$
Уравнение изохоры (закон Шарля)
В этом случае dV=0, δA=pdV=0, т.е. все подводимое к газу тепло идет на увеличение его внутренней энергии. Из уравнения (2) следует, что молярная теплоемкость газа при постоянном объеме
$$C_V=\frac {dU}{dT}$$
Формула 4
2. Изобарный процесс протекает при постоянном давлении (p=const). Уравнение изобары (закон Гей-Люссака) имеет вид: V / T = const . В этом случае уравнение (2) принимает вид:
$$C_p= \frac{dU}{dT}+p( \frac{dV}{dT})$$
Формула 5
Из уравнения (3) следует, что
$$pdV+Vdp=RdT$$
Формула 6
Но при p=cont dp=0, следовательно, pdV=RdT.Подставляя это выражение в уравнение (5) и заменяя dU через CVdT, получаем:
$$C_P=C_V+R$$
Формула 7
Молярные теплоемкости CP и CV идеального газа зависят от числа степеней свободы i его молекулы – наименьшего числа координат, которые необходимо задать, чтобы полностью определить положение молекулы в пространстве. Молекула (точнее, атом) одноатомного газа имеет i=3 степени свободы поступательного движения: координаты x, y, z.
Если рассматривать молекулу двухатомного газа как два жестко связанных атома, находящихся на некотором расстоянии друг от друга, то такая молекула помимо трех степеней свободы поступательного движения имеет еще две степени вращательного движения вокруг осей, перпендикулярных к линии, соединяющей атомы. Молекулы, состоящие из трех и более атомов, имеют i=6 шесть степеней свободы: три степени свободы поступательного движения и три степени свободы вращательного движения.
При высоких температурах кроме поступательного и вращательного движений молекулы существуют еще и колебания атомов в молекуле около положений равновесия, т.е. добавляются колебательные степени свободы. У двухатомной молекулы одна колебательная степень свободы, у много- атомной – 3N-6, где N – число атомов в молекуле. На каждую степень свободы молекулы в среднем приходится одинаковая кинетическая энергия, равная kT/2, где k – постоянная Больцмана. Тогда внутренняя энергия одного моля идеального газа равна
$$U=\frac {i}{2}kTN_a=\frac {i}{2}RT$$
Формула 8
где i – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы (так как колебательное движение связано с наличием и кинетической, и потенциальной энергий, причем средние значения этих энергий одинаковы). Из (4), (7) и (8) следует, что
$$C_V=\frac{i}{2}R,$$
$$C_p=\frac{i+2}{2}R$$
Формула 9
3. Изотермический процесс протекает при постоянной температуре (Т=const). Уравнение изотермы (закон Бойля − Мариотта): pV=const. Так как dT=0, dU=0, δQ=δA, все подводимое к газу тепло расходуется на работу.
4. Адиабатный процесс протекает без теплообмена с окружающей средой. Первое начало термодинамики в этом случае имеет вид:
$$dU+\delta A=0$$
Формула 10
Для одного моля идеального газа:
$$dU=C_VdT,$$
$$dA=pdV$$
Формула 11
Здесь CV – молярная теплоемкость при постоянном объеме газа; р – давление; dT и dV – бесконечно малые изменения температуры и объема соответственно. Подставляя (11) в (10), получаем
$$C_VdT+pdV=0$$
Формула 12
Дифференцируя уравнение (3), находим связь между параметрами dp, dV и dT:
$$pdV+Vdp=RdT$$
или
$$dT=\frac{1}{R}(pdV+Vdp)$$
Формула 13
Подставляя (13) в (12), получаем дифференциальное уравнение, связывающее объем и давление идеального газа в адиабатном процессе:
$$(C_V+R)*pdV+C_V dp=0$$
Формула 14
Учитывая (7), из соотношения (14) получаем
$$\frac {C_p}{C_V}*\frac {dV}{V}+\frac {dp}{p}=0$$
Формула 15
Так как для идеального газа молярные теплоемкости CV и CP не зависят от температуры (9) и считая воздух при атмосферном давлении идеальным газом, получаем, что показатель CV/ CP – постоянная для данного газа величина. В этом случае решение дифференциального уравнения имеет вид:
$$pV^{C_p/C_V}=cont$$
или
$$pV^\gamma=const$$
Формула 16
Уравнение (16) называют уравнением адиабаты (уравнением Пуассона), а показатель γ=CV/CP – показателем адиабаты (показателем Пуассона).
В данной работе определение γ=CV/CP производится одним из классических методов, основанных на исследовании некоторой массы газа, последовательно проходящей через три состояния. Из первого состояния во второе газ переходит путем адиабатного расширения; из второго в третье – изохорно, причем конечная температура в изохорном процессе равна начальной (комнатной) температуре.
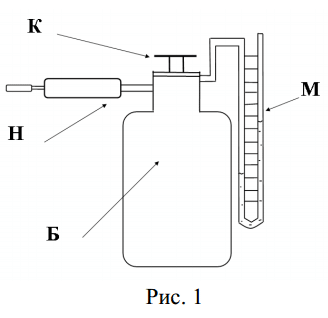
Схема экспериментальной установки представлена на рис. 1. Она состоит из стеклянного баллона Б, снабженного двухходовым краном К, манометра М и насоса Н. В баллон насосом накачивают воздух до давления, несколько превышающего атмосферное. Процесс установления атмосферного давления в баллоне происходит достаточно быстро.
Быстрое изменение давления в сосуде происходит практически без теплообмена с окружающей средой, поэтому процесс, происходящий при открывании крана К, с достаточной точностью можно считать адиабатным.
Пусть с помощью насоса Н в баллон накачали воздух, затем закрыли кран К. Через 2-3 минуты температура воздуха в баллоне за счет теплообмена станет равной температуре в лаборатории. Обозначим эту температуру Т1. Давление воздуха в баллоне р1 при этом равно
$$p_1=p_0+p’$$
Формула 17
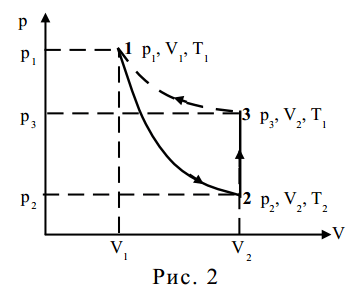
где р0 – атмосферное давление; р’ – избыточное давление воздуха, p которое можно определить по показаниям манометра. Выберем мысленно в сосуде объем V вдали от крана К. Будем считать, что число молекул в этом «объеме» неизменно. В пересчете на один моль газа после выравнивания температур молярный объем газа будет V1, давление р1 и температура Т1 (точка 1 на рис. 2).
Если открыть на короткое время кран К, то часть воздуха выйдет из сосуда, давление станет равным р2=р0, выбранный нами «объем» увеличится до значения V2. Температура воздуха понизится, Т2<Т1, так как при вытекании из баллона Б воздух совершает работу против давления окружающего баллон воздуха. В тот момент времени, когда кран закрывают, состояние «объема» характеризуется параметрами р2, T2, V2, где р2 – атмосферное давление (точка 2 на рис. 2).
Считая переход из состояния 1 в состояние 2 адиабатным процессом, так как он происходит достаточно быстро, из формулы (16) получаем
$$p_1V_1^{C_p/C_V}=p_2V_2^{C_p/C_V}$$
Формула 18
После того как кран К закрыли, в течение 2-3 минут происходит изохорный процесс теплообмена с окружающей средой. При этом температура воздуха приближается к температуре в лаборатории Т1 и давление воздуха по окончании этого процесса повышается до величины р3:
$$p_3=p_0+p»$$
Формула 19
где р» измеряется по манометру М. Параметры воздуха после окончания изохорного процесса − р3, Т1, V3 , причем V3=V2 (точка 3 на рис. 2).
Так как температуры воздуха в первом и третьем состояниях одинаковы, а число молекул в выбранном нами «объеме» постоянно (объем V выбран вдали от крана К), то для состояний 1 и 3 можно применить закон Бойля − Мариотта:
$$p_1V_1=p_3V_3=p_3V_2$$
Формула 20
Решая систему уравнений (20), (18) получаем
$$(p_3/p_1)^{C_p/C_v}=p_2/p_1$$
Прологарифмировав это соотношение, найдём
$$\gamma=C_p/C_V=\frac{ln(p_1/p_2)}{ln(p_1/p_3)}$$
Формула 21
В условиях данного опыта давление р2 равно атмосферному и разность уровней жидкостей в трубках манометра в этом случае равна нулю.
Давление воздуха в баллоне в начальном состоянии p1 = p2 + ρgH,
где ρ – плотность жидкости в манометре; g – ускорение свободного падения; Н – разность уровней жидкости в трубках манометра при измерении р1.
Давление воздуха в баллоне в третьем состоянии p3 = p2 + rgh,
где h – разность уровней жидкости в трубках манометра при измерении р3.
Так как давления р1 и р3 мало отличаются от атмосферного р2, то формулу (21) можно упростить, воспользовавшись приближенным равенством ln(1 + x) ~ x , которое выполняется для всех х<<1. Тогда:
$$gamma=\frac {ln(1-\rho gH/p_1)}{ln(1-\rho g(H-h)/p_1)}\cong \frac{H}{H-h}$$
Формула 22
Величина h в формуле (22) получена в предположении, что кран К закрывается в момент окончания адиабатного процесса 1—2 (рис. 3).
Если кран закрыть до завершения процесса 1—2, т.е. в тот момент, когда давление в баллоне снизится до р’2, но еще не достигнет атмосферного р2, то, как видно из рис. 3, разность уровней жидкости в манометре h’ после процессов расширения и изохорного нагревания, определяемая ординатой 2′—3′, окажется завышенной, что, как следует из расчетной формулы (22), приводит к увеличению величины γ по сравнению с ее действительным значением. Если кран закрыть спустя некоторое время после завершения адиабатного процесса, то за это время температура воздуха в баллоне немного повысится за счет теплообмена с окружающей средой (изобарный процесс 2—2″ на рис. 3). Соответствующая разность уровней h», определяемая ординатой 2″—3″, окажется заниженной, что приведет к уменьшению γ.
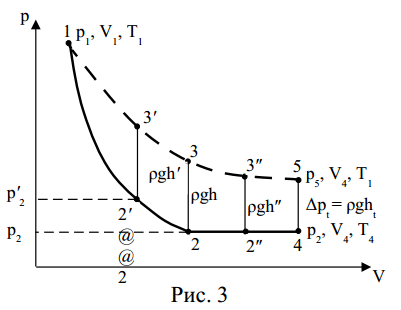
Для получения правильного результата измерения кран К необходимо закрыть в тот момент, когда газ находится в состоянии 2, что сделать практически невозможно. Ввиду этого ординату 2—3, соответствующую разности уровней h, приходится определять косвенным путем.
Рассмотрим с этой целью процесс адиабатного расширения 1—2 при открытом кране с учетом теплообмена с окружающей средой во время протекания процесса 2—4 (рис. 3).
Процессы, происходящие в сосуде, не являются квазиравновесными, поэтому графики, строго говоря, строить нельзя (в случае неравновесного процесса нельзя говорить о давлении и температуре газа, так как в разных частях баллона эти величины могут иметь различные значения). На рис. 3 обозначены: 1—2 – адиабатный процесс, 2—4 – изобарный процесс, протекающий в баллоне при открытом кране после завершения адиабатного расширения, 4—5 – изохорный процесс, протекающий после закрытия крана. Точки 1, 3, 5 лежат на изотерме, соответствующей температуре Т1.
Допустим, что газ находится в состоянии 1. Открыв кран, произведем адиабатное расширение. При этом температура газа понизится относительно комнатной до температуры Т2, давление станет равным атмосферному р2 (процесс 1—2). Если по окончании процесса 1—2 кран оставить открытым на время t, то температура газа в баллоне за это время повысится за счет теплообмена до величины Т4 (изобарный процесс 2—4).
Закроем после этого кран и оставим баллон закрытым до тех пор, пока температура внутри баллона не станет равной температуре окружающей среды Т1 (изохорный процесс 4—5). При этом давление газа в баллоне повысится на некоторую величину Δрt, определяемую по соответствующей разнице уровней жидкости в манометре ht. С уменьшением времени t величина ht, как это видно из рис. 3, возрастает и в пределе при t→0 стремится к некоторому значению h (ht→h).
Следовательно, величину h можно определить, имея график зависимости ht от t, полученный опытным путем. Можно показать, что в условиях нашего опыта имеет место соотношение
$$ln(h_t)=ln(h)-at$$
Формула 23
где а – некоторая константа. Получив на опыте ряд значений
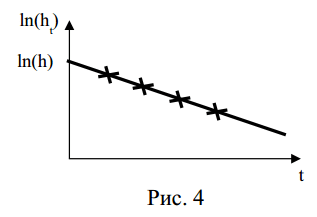
ln(ht) , соответствующих различным длительностям расширения t от одного и того же значения р1, нанесем их на график зависимости
ln(ht ) =f (t ) . Соединив полученные точки прямой и продолжив ее до пересечения с осью ординат, найдем логарифм искомой величины h (рис. 4).
.
Порядок выполнения работы
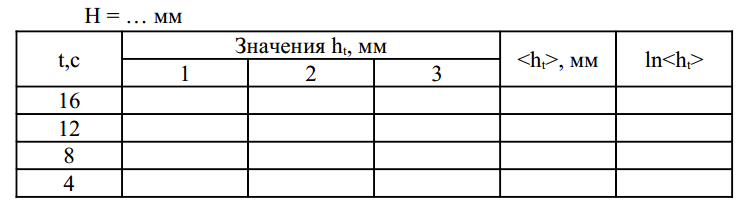
- Насосом Н накачайте в баллон Б воздух так, чтобы разность уровней жидкости в манометре М стала равной 200 – 250 мм. Закройте кран К и выждите 2…3 минуты до тех пор, пока температура воздуха в баллоне не станет равной температуре окружающего воздуха. Занесите в таблицу (см. приложение) значение модуля разности показаний манометра H = H2 — H1 .
- Откройте кран К и одновременно включите секундомер. Выдержав кран открытым 16 секунд, быстро закройте его. Через 2…3 минуты (после того, как уровни жидкости в манометре стабилизируются) занесите в таблицу значение модуля разности показаний манометра ht = |h2 — h1|
- Пункты 1 и 2 повторите еще два раза.
Внимание ! Не забудьте перед каждым новым опытом полностью открывать кран К, чтобы выровнять уровни жидкости. Накачивать воздух в баллон целесообразно осторожно, чтобы нижний уровень жидкости не достиг колена манометра. Перед каждым опытом после выравнивания температур до открытия крана К уровень жидкости в одной из трубок манометра следует осторожно, с помощью насоса, устанавливать на то же деление, что и в первом опыте.
4. Проведите измерения по пунктам 1-3 для времени t, равного 12, 8 и 4 секундам.
5. По данным таблицы на миллиметровой бумаге постройте график ln(ht ) = f (t ) . Через полученные точки проведите прямую и определите ln(h) как точку пересечения этой прямой и оси ординат. По полученному значению ln(h) определите h и подставьте в формулу (22) для расчета показателя адиабаты γ.
6. Сравните экспериментальный показатель адиабаты γ с теоретическим значением, считая воздух смесью двухатомных газов.
7. Оцените погрешность результата измерений Δγ. Сделайте соответствующие выводы.
Вопросы и задания для самоконтроля
-
Сформулируйте первое начало термодинамики. Примените его к различным изопроцессам.
.
-
Какой процесс называется адиабатным?
.
-
Обоснуйте зависимость теплоемкости газа от числа степеней свободы его молекул.
.
Библиографический список
- Савельев И.В. Курс общей физики. Т. 1. — М.: Наука, 1982. — С. 268-273, 277-282.
- Трофимова Т.И. Курс физики: учеб. пособие для вузов. — М.: Выс- ш.шк., 2001. — С. 100-110.
Приложение
Таблица экспериментальных данных
УДК 536(075.8)
Определение отношения CP/CV для воздуха методом Клемана-Дезорма: методические указания к лабораторной работе / Рязан. гос. радиотехн. ун-т; сост.: А.С. Иваников, Ю.В.Черкасова. – Рязань, 2015. – 8 с.
Содержат описание лабораторной работы по курсу общей физики (раздел молекулярной физики и термодинамики). Приведены общие теоретические сведения, описание методики и экспериментальной установки, необходимые для выполнения лабораторной работы.
Предназначены для студентов всех специальностей, изучающих дисциплину «Физика».
Табл. 1. Ил. 4. Библиогр.: 2 назв.
Теплоемкость, адиабатный процесс, формула Майера, уравнение Пуассона, манометр, насос
Печатается по решению редакционно-издательского совета Рязанского государственного радиотехнического университета.
Рецензент: кафедра общей и экспериментальной физики РГРТУ (зав. кафедрой доц. М.В. Дубков)
Определение отношения CP/CV для воздуха методом Клемана-Дезорма
Составители: Иваников Александр Сергеевич Черкасова Юлия Вадимовна
Редактор Р.К. Мангутова Корректор С.В. Макушина
Подписано в печать 02.02.15. Формат бумаги 60 x 84 1/16.
Бумага писчая. Печать трафаретная. Усл. печ. л. 0,5.
Тираж 200 экз. Заказ
Рязанский государственный радиотехнический университет.
390005, Рязань, ул. Гагарина, 59/1.
Редакционно-издательский центр РГРТУ.
